- mars 1, 2021
Covid-19 et complications cardiovasculaires, les nouveautés qui font vibrer…
Depuis le déclenchement de la pandémie COVID-19 liée à l’infection au virus SARS-CoV-2, le bilan sanitaire et socio-économique s’alourdit sans véritable maitrise de la situation. Une compréhension scientifique de la maladie s’enrichie de jour en jour avec toujours des zones d’ombres qui restent à éclairer et un besoin continu de mettre au point les trouvailles scientifiques. La lésion cardiaque dans le cadre de l’infection à COVID-19, estimée initialement à 20%(1), peut varier de phénomènes thrombotiques veineux ou artériels, et de myocardites. Elle constitue un facteur de mauvais pronostic avec une surmortalité démontrée.(1)
La lésion myocardique secondaire à la Covid-19 a été initialement dichotomisée en, soit une atteinte directe liée au virus (entrée cellulaire du virus via le récepteur ACE-2), soit indirecte conséquente de l’orage cytokinique(2). La mise en évidence du virus dans les biopsies myocardiques, ce qui pourrait distinguer les deux entités avec certitude, n’est pas de pratique courante et ne permet pas à elle seule d’affirmer le diagnostic de myocardite. Certains auteurs ont proposé plutôt d’utiliser le terme de myocardite associée à la COVID-19 (3).
Très récemment (en janvier2021), une revue de littérature (4) vient d’être annoncée et a souligné cette méconnaissance des mécanismes des lésions myocardiques. En se basant sur les résultats de 277 autopsies cardiaques réparties sur 22 publications séparées à propos de cas COVID-19, la myocardite était présente dans 20 cas soit une incidence de 7.2%. Cependant l’analyse attentive des données a montré une surestimation de cette incidence qui ne dépasse pas les 2%.
En effet, Il n’y a pas de définition formelle de myocardite pour les autopsies, mais, les critères de Dallas développés pour les biopsies endo myocardiques, définissent la myocardite comme un infiltrat inflammatoire adjacent à des foyers de myocytes lésés(5). Encore, un infiltrat inflammatoire, même lymphocytaire, isolé ne permet pas de retenir le diagnostic de myocardite sans nécrose myocardique(6). Des anomalies histopathologiques particulières, ont été, cependant, décrites dans 47.8% des cas à savoir des thrombi micro et macrovasculaires, l’inflammation et des mégacaryocytes intraluminaux. Ces anomalies pourraient avoir été omises ou négligées par certaines publications donc elle seraient sous estimées. D’autant plus, la comparaison attentive, par KAWAKAMI R et al (7), des échantillons de myocardites Covid-19 (fatales et non fatales) aux myocardites non dues au SARS-Cov-2, a montré des différences, à savoir : dans les premiers, il y a plus de macrophage que de lymphocytes T et sans nécrose myocardique par opposition aux cas contrôles où les lymphocytes prédominent les macrophages avec une nécrose myocardique significative (Figure 1). Ces constatations mettent en exergue que l’atteinte cardiaque au cours du Covid-19 ne s’aligne pas avec les autres atteintes virales, serait-il plutôt une association de phénomènes inflammatoires et thrombotiques touchant la microcirculation avec même une hypothèse de production locale de plaquettes vu les mégacaryocytes identifiés in situ. Ces théories se trouvent d’autant plus plausibles avec les cas correctement documentés comme par exemple le cas (publié dans Circulation) d’une dame de 43 ans décédée des suites de La Covid19 dans un contexte d’état de choc cardiogénique réfractaire avec sus décalage ST inférolatéral et coronarographie normale. Elle a été étiquetée myocardite fulminante jusqu’à l’analyse autopsique exhaustive du cœur qui n’a pas trouvé de virus ni d’aspect de myocardite, plutôt des microthrombi touchant la microcirculation et responsable de large ischémie myocardique (8).
Bref, des myocardites-proprement dites-fatales sont rares mais il ne faut pas méconnaitre cette association inflammation- état micro thrombotique qui fait croiser les entités cliniques et compliquer la prise en charge. En d’autre bras, Il y avait un contraste entre le faible pourcentage retenu de Myocardite sur les données autopsiques en comparaison avec les données d’IRM cardiaques (60%) chez des survivants jeunes (4). S’agit-il de différence d’impact du virus en fonction de l’âge et de comorbidités ou plutôt de la réponse immunologique ? la curiosité scientifique est croissante à étiqueter histologiquement ces aspects radiologiques, mais elle est heurtée par la discordance entre l’iatrogénie de la biopsie endo myocardique et la bonne tolérance clinique des lésions myocardiques en question. La piste de réponse immunologique est de plus en plus soutenue. En effet, une revue de littérature publiée il y a deux semaines (9) et analysant les mécanismes de thromboses et de complications cardiovasculaires (AVC, IDM, l’embolisation artérielle, l’embolie pulmonaire, myocardite…) a proposé une explication à l’immuno-thrombose et l’interaction inflammation et système de coagulation (figure 2). Cette meilleure compréhension des mécanismes de complications cardiovasculaires vise à déboucher sur des attitudes thérapeutiques plus rationnelles. En effet, le Ticagrelor a été proposé pour la thromboprophylaxie pour ses vertus de bloquer l’activation et l’agrégation plaquettaire d’une part et de réduire le taux des médiateurs de l’inflammation (IL-6, TNF-α, IL-8), d’autre part, ainsi que le risque de coagulation intravasculaire disséminée (CIVD) (10). Ceci d’autant plus que le rôle de l’héparine dans la réduction de surmortalité n’a été récemment prouvé que chez les patients avec des critères de CIVD ou des taux de DD-mères élevés (11). Des études randomisées sont nécessaires pour répondre à ces questions.
Finalement, concernant les complications cardiovasculaires liées au Covid-19, est-il utile de s’acharner à étiqueter, probablement à tort, ces complications sous les rubriques Myocardite, syndrome coronaire aigu ou autre ? il s’est avéré qu’on n’en sache pas trop sans étude histologique et que c’est plus raisonnable de considérer à chaque fois cette triade Inflammation, réaction immunologique et état pro-thrombotique à l’échelle de la microcirculation. Cependant, le défi qui reste à soulever est de trouver le bon cocktail thérapeutique (Anticoagulant, antiagrégants plaquettaires, anti-inflammatoires, immunosuppresseurs, …) et qu’il soit adapté à chaque profil de patient.
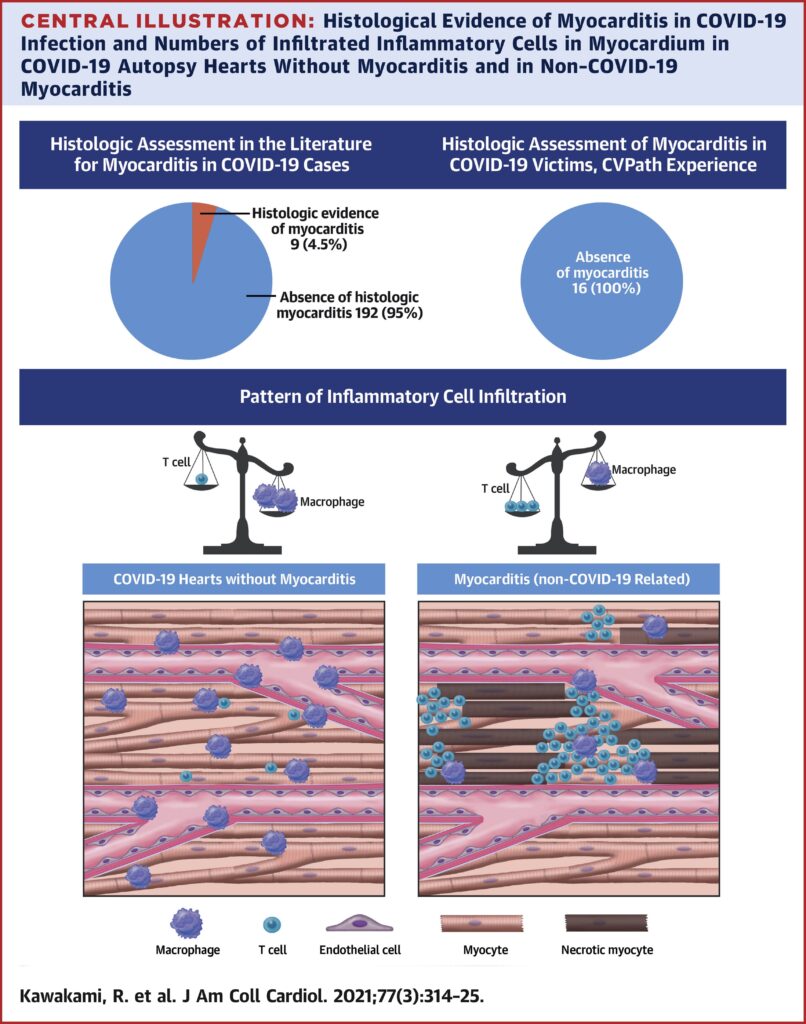
Figure1 : schéma des différences histologiques entre les lésions cardiaques en cas de Covid-19 et des myocardites non Covid-19
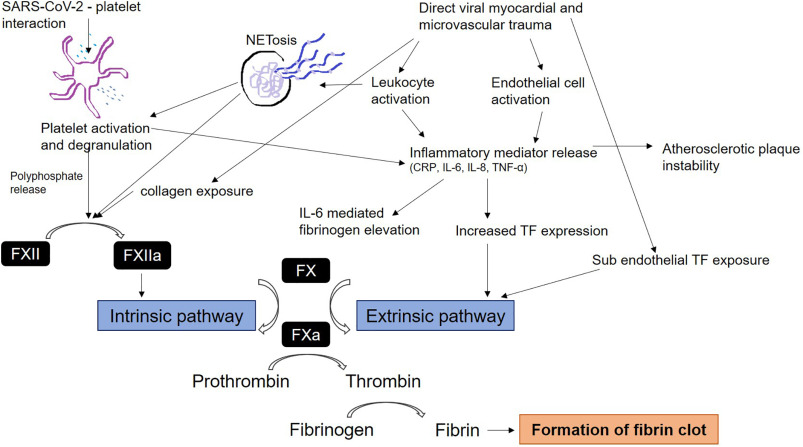
Mechanisms of thrombosis and cardiovascular complications in COVID-19. Eden M.et al. Thrombosis
Research Volume 200, April 2021, Pages 1-8
Figure 2 : les mécanismes d’immuno-thrombose en cas de Covid-19 et les interactions entre les systèmes de coagulation et d’inflammation.
CRP = C-Reactive Protein, IL-6 = Interleukin 6, IL-8 = Interleukin 8, TNF-α = Tumour necrosis factor α,
TF = Tissue factor, FXII = coagulation factor XII, FXIIa = activated coagulation factor XII,
FX = coagulation factor X, FXa = activated coagulation factor X.
Références bibliographiques :
1. Shi S, Qin M, Shen B, Cai Y, Liu T, Yang F, et al. Association of Cardiac Injury With Mortality
in Hospitalized Patients With COVID-19 in Wuhan, China. JAMA Cardiol. juill
2020;5(7):802‑10.
2. Siripanthong B, Nazarian S, Muser D, Deo R, Santangeli P, Khanji MY, et al. Recognizing
COVID-19-related myocarditis: The possible pathophysiology and proposed guideline for
diagnosis and management. Heart Rhythm. sept 2020;17(9):1463‑71.
3. Fard D, Huguet R, Koutsoukis A, Deguillard C, Tuffreau A-S, Deux J-F, et al. Myocardite et
maladie à COVID-19 : où en est-on ? Ann Cardiol Angeiol (Paris). déc 2020;69(6):349‑54.
4. Halushka MK, Vander Heide RS. Myocarditis is rare in COVID-19 autopsies: cardiovascular
findings across 277 postmortem examinations. Cardiovasc Pathol. 1 janv 2021;50:107300.
5. Leone O, Veinot JP, Angelini A, Baandrup UT, Basso C, Berry G, et al. 2011 Consensus
statement on endomyocardial biopsy from the Association for European Cardiovascular
Pathology and the Society for Cardiovascular Pathology. Cardiovasc Pathol. juill
2012;21(4):245‑74.
6. Basso C, Aguilera B, Banner J, Cohle S, d’Amati G, de Gouveia RH, et al. Guidelines for
autopsy investigation of sudden cardiac death: 2017 update from the Association for
European Cardiovascular Pathology. Virchows Arch Int J Pathol. déc 2017;471(6):691‑705.
7. Kawakami Rika, Sakamoto Atsushi, Kawai Kenji, Gianatti Andrea, Pellegrini Dario, Nasr
Ahmed, et al. Pathological Evidence for SARS-CoV-2 as a Cause of Myocarditis. J Am Coll
Cardiol. 26 janv 2021;77(3):314‑25.
8. Guagliumi Giulio, Sonzogni Aurelio, Pescetelli Irene, Pellegrini Dario, Finn Aloke V.
Microthrombi and ST-Segment–Elevation Myocardial Infarction in COVID-19. Circulation.
25 août 2020;142(8):804‑9.
9. Mechanisms of thrombosis and cardiovascular complications in COVID-19 – ScienceDirect
[Internet]. [cité 4 févr 2021]. Disponible sur:
https://www.sciencedirect.com/science/article/pii/S0049384821000141
10. Can Ticagrelor be used to prevent sepsis-induced coagulopathy in COVID-19? [Internet].
[cité 4 févr 2021]. Disponible sur:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7240255/
11. Tang N, Bai H, Chen X, Gong J, Li D, Sun Z. Anticoagulant treatment is associated with
decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J
Thromb Haemost JTH. mai 2020;18(5):1094‑9.