- janvier 10, 2023
COMMENT RÉALISER UNE ÉCHOGRAPHIE PULMONAIRE CHEZ LE PATIENT INSUFFISANT CARDIAQUE ?
L’Association européenne d’imagerie cardiovasculaire (EACVI), ainsi que les recommandations 2021 de la Société européenne de cardiologie (ESC) pour le diagnostic et le traitement de l’insuffisance cardiaque aiguë et chronique reconnaissent l’importance de l’échographie pulmonaire en cas de suspicion d’insuffisance cardiaque. Cette mise au point vise à fournir aux praticiens, en particulier aux cardiologues, des informations pratiques pour effectuer une échographie pulmonaire, en complément de l’échocardiographie transthoracique ( ETT) pour évaluer avec précision la congestion pulmonaire chez les patients souffrant d’une insuffisance cardiaque.
Bien qu’une sonde convexe de 5 MHz puisse fournir une visualisation optimale du parenchyme pulmonaire, une sonde cardiaque standard avec une gamme de fréquences de 3,5 à 5,0 MHz permet une visualisation suffisante de la plèvre et des structures sous-pleurales. La petite surface de la sonde cardiaque permet un balayage facile le long des espaces intercostaux.
Contrairement à l’ETT, la fenêtre acoustique de l’échographie pulmonaire est toujours accessible . Le patient peut être examiné en position assise ou couchée. En utilisant la ligne axillaire antérieure comme repère, chaque paroi thoracique peut être divisée en quatre régions pulmonaires (parties supérieure et inférieure de la paroi thoracique antérieure et latérale) qui doivent être systématiquement analysées. Un balayage supplémentaire de la paroi thoracique postérieure peut être utile pour évaluer la présence d’un épanchement pleural mais n’est généralement pas nécessaire pour l’évaluation de la congestion pulmonaire. Lors de l’utilisation d’une sonde convexe, la sonde peut être positionnée perpendiculairement aux côtes, ainsi que le long des espaces intercostaux. Lors de l’utilisation d’une sonde cardiaque, cependant, la position raisonnable est le long de l’espace intercostal, où la longueur de la sonde peut occuper l’espace intercostal sans toucher les côtes.
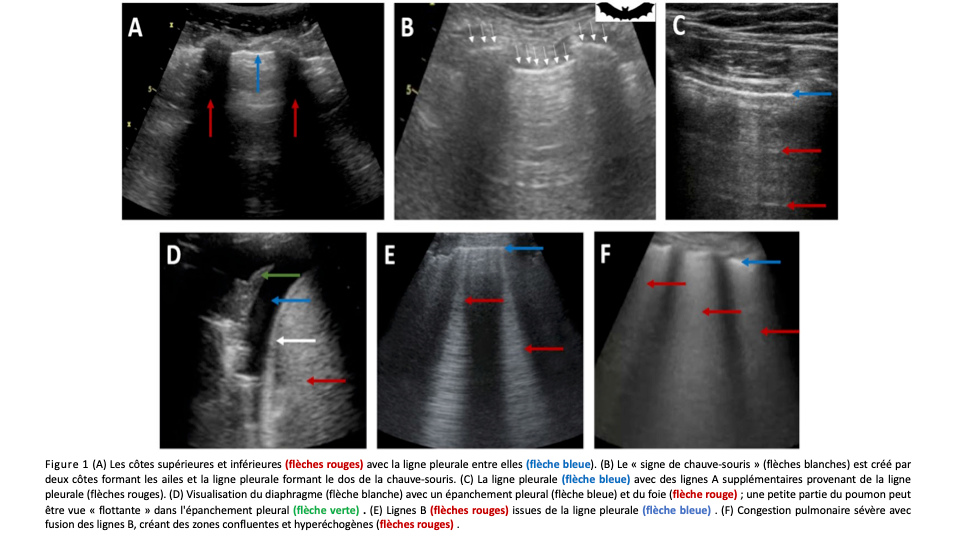
Dans un poumon normalement aéré, la ligne pleurale sera la seule structure qui peut être visualisée avec l’échographie pulmonaire. La ligne pleurale est visualisée comme une ligne hyperéchogène, mince et horizontale qui va et vient avec la respiration et résulte du mouvement de la plèvre viscérale contre la plèvre pariétale pendant le cycle respiratoire. L’approche de balayage perpendiculaire, qui est généralement réalisée avec une sonde microconvexe, visualise les côtes supérieures et inférieures, qui sont caractérisées par un ombrage postérieur. Ensuite, la ligne pleurale peut être située entre les deux côtes (Figure 1A). CLa visualisation des côtes supérieures et inférieures en combinaison avec la ligne pleurale identifiera le « signe de chauve-souris » (Figure 1B). Cependant, ce signe n’est pas toujours observé avec une sonde cardiaque. Il est important de noter que la ligne pleurale doit se déplacer avec l’inspiration et l’expiration. Si une ligne horizontale immobile est visualisée, il peut S’agir d’un fascia musculaire ou, en cas de dyspnée aiguë et inexpliquée, d’un pneumothorax sous-jacent. Certaines lignes horizontales hyperéchogènes supplémentaires peuvent survenir à intervalles réguliers à partir de la ligne pleurale et sont appelées ‘ lignes A’ (Figure 1C). CCes lignes A sont des artefacts de réverbération qui représentent un signe de teneur normale ou accrue d’air dans les poumons. (par exemple, une maladie pulmonaire obstructive chronique) L’échographiste doit également toujours essayer de localiser le diaphragme car les condensations pulmonaires et les épanchements pleuraux se trouvent principalement dans les régions pulmonaires inférieures et peuvent donc être différenciés des organes intra-abdominaux une fois le diaphragme identifié (Figure 1D). Étant donné que l’air provoque une réflexion complète du faisceau ultrasonore, le parenchyme pulmonaire ne peut pas être visualisé dans le poumon normalement aéré.
Avec l’augmentation de la congestion pulmonaire et de la perte d’aération, la densité pulmonaire augmente et l’inadéquation acoustique entre le poumon et les tissus environnants est réduite. Cela crée des artefacts de réverbération verticale qui sont également connus sous le nom de «lignes B». Les lignes B sont des artefacts verticaux bien définis qui se déplacent en synchronisation avec la ligne pleurale. Ils ont un aspect hyperéchogène, naissent de la ligne pleurale et atteignent le bord de l’écran2 (Figure 1E). Bien que moins d’une ou deux lignes B puissent parfois être détectées dans les zones pulmonaires de poumons normalement aérés, la présence de plus de deux lignes B est presque toujours un signe pathologique. Cependant, étant donné que les lignes B ne sont qu’une expression de la perte d’aération pulmonaire, elles ne sont pas pathognomoniques de la congestion pulmonaire. Pour poser le diagnostic de congestion pulmonaire, les lignes B doivent être multiples (deux lignes B ou plus dans une seule zone de balayage), diffuses (détection de lignes B dans plusieurs zones de balayage) et bilatérales. Les lignes B limitées à une ou deux zones pourraient être le signe d’une pneumonie sous-jacente ou d’une athélectasie, alors qu’une distribution inhomogène avec des zones épargnées pourrait être le signe d’un syndrome de détresse respiratoire aiguë ou d’une fibrose pulmonaire. Le nombre de lignes B est bien corrélé avec le degré de perte d’aération pulmonaire. De plus, le nombre de lignes B diminue immédiatement après le début du traitement décongestionnant, faisant de l’échographie pulmonaire un outil précieux pour suivre l’amélioration de la congestion pulmonaire pendant le traitement diurétique. Lorsqu’il n’y a que peu de lignes B, elles peuvent être comptées individuellement et la somme des lignes B trouvées dans chaque région pulmonaire fournit un score total qui démontre la sévérité du syndrome alvéolo-interstitiel et permet un suivi plus objectif après le début du traitement diurétique. Lorsque les lignes B sont nombreuses, elles ont tendance à fusionner et à former des zones bien distinctes, hyperéchogènes et confluentes (Figure 1F). Dans ces cas, le pourcentage du site de balayage occupé par ces « zones blanches » peut être utilisé comme mesure semi-quantitative. Outre les lignes B, la présence d’un épanchement pleural pourrait également être un signe de congestion pulmonaire progressive. Lors de la recherche d’épanchements pleuraux, l’opérateur doit d’abord examiner les régions inférieures des deux poumons. Un épanchement pleural sera principalement considéré comme une structure hypo ou anéchogène délimitée par la paroi thoracique et le diaphragme (Figure 1D). Bien que l’étiologie d’un épanchement pleural ne puisse pas toujours être détectée avec précision par le LUS, un transsudat (observé dans la congestion pulmonaire) est toujours anéchogène. Une congestion pulmonaire très sévère, un œdème pulmonaire ou un épanchement pleural important comprimant le parenchyme pulmonaire peuvent tous induire une perte importante d’aération pulmonaire. Chez ces patients, la fenêtre acoustique sur le poumon devient complètement ouverte, montrant la présence d’une atélectasie de compression (Figure 1D). Une atélectasie de compression apparaît comme une structure tissulaire hyperéchogène qui peut être visualisée comme un parenchyme solide (comme le foie).
L’échographie pulmonaire est une compétence essentielle pour tout médecin traitant des patients souffrant d’insuffisance cardiaque et peut être facilement utilisée en complément de l’échocardiographie transthoracique standard. Une connaissance adéquate de cet examen permet un diagnostic rapide de la congestion pulmonaire et peut aider le clinicien dans la prise en charge initiale ainsi que dans le suivi des patient insuffisants cardiaques présentant une congestion pulmonaire.